Cambio Climático y Pastizales con mecanismo fotosintético C4
Por: Fiorella Eduardo-Palomino
Luego de pasar los últimos 5 años aprendiendo y trabajando con pastizales altoandinos del Perú que están formados principalmente por pastos C3 como las Festucas (ex: Festuca dolichophylla - chilligua) o Calamagrostis (algunos que ya son del género Deyeuxia), fue para mí una agradable sorpresa aprender en el curso de Ecología de pastizales del semestre pasado que los pastizales en Estados Unidos están principalmente formados por pastos con el mecanismo fotosintético C4 como los andropogon (Andropogon gerardii -Big blue stem) lo cual tiene mucho sentido porque son pastizales que deben ser muy eficientes con el uso del agua. Al revisar la lista de plantas del estrato herbáceo del bosque estacionalmente seco con el cual estaba trabajando en ese momento también me di cuenta de que la mayoría de las Poaceae son C4.
Pastizales que tienen gramíneas dominantes con un mecanismo fotosintético C3 muestran una ventaja ecológica en respuesta al cambio climático por que ellos pueden usar la gran cantidad de CO2 atmosférico para aumentar el proceso de fotosíntesis y en consecuencia aumentar la producción de biomasa. Por otro lado, los pastos que evolucionaron en un mecanismo fotosintético C4 no han mostrado alguna ventaja ecológica todavía. Parte de mi examen fue encontrar, con los conocimientos que nos habían dado en clase y con ayuda de nuevas publicaciones, si los pastizales dominados por plantas C4 mostrarían alguna ventaja a futuro y a continuación les cuento lo que encontré.
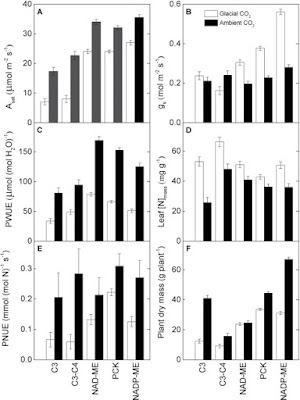
La hipótesis de bajas concentraciones de CO2 en la atmosfera durante el Olicoseno (hace 30 millones de años aprox.) explicarían el origen del mecanismo fotosintético C4 en las gramíneas, que también ocasionó aridez en áreas tropicales (Pinto, 2014; Sage, 2012; Gibson, 2009). En un escenario de cambio climático se espera lo opuesto, un incremento en el CO2 atmosférico. Experimentos con gramíneas como Poa pratensis (C3) y Andropogon gerardii (C4) mostraron que la tasa de fotosíntesis en gramíneas C3 incremento en altas concentraciones de CO2 igualando la tasa de fotosíntesis en gramíneas C4 en condiciones normales (Nie et al. 1992 in Kirkham, 2011). Como se observa en la figura 1, la gramínea C4 no mostró ningún cambio en las tasas de fotosíntesis en presencia de altas concentraciones de CO2. Sin embardo el contenido de proteína de la gramínea C3 se redujo en altas concentraciones de CO2 (Morgan et al., 2004) mientras que la gramínea C4 conservó su contenido de proteína. Este comportamiento puede ser explicado por la eficiencia en el uso de nitrógeno durante la fotosíntesis que algunas gramíneas presentan, como el ejemplo de Panicum milioides (Pinto et al. 2014) que se muestra en la figura 2.
|
|
Figura 1. El grafico muestra la variación en la taza de fotosíntesis de Poa pratensis (C3) y Andropogon gerardii (C4) en bajas (354 µmol/mol) y altas (715 µmol/mol) concentraciones de carbono y bajas (sin agua) y altas (capacidad de campo) concentraciones de agua en el suelo. Promedio de mediciones 8-16 (Nie et al. 1992 in Kirkham, 2011). Con alta y baja presencia de agua en el suelo la tasa de fotosíntesis de Poa pratensis (C3) incremento en altas concentraciones de CO2 y Andropogon gerardii (C4) se mantuvo igual en ambos ambientes.
|
Figura 2. Parámetros de crecimiento. Fotosintesis saturada de luz, Asat (A), conductancia estomática, gs (B), eficiencia del uso del agua fotosintética, PWUE (C), nitrogeno en la hoja por unidad de materia seca, [N]mass (D), Eficiencia del uso de nitrógeno fotosintético, PNUE (E), y materia seca, PDM (F) de 10 especies de gramíneas C3, C3–C4, and C4 (NAD-ME, PCK, NADP-ME) tipos fotosintéticos cultivados en glacial (180 μl l–1, barras sin relleno) o al ambiente (400 μl L–1, barras rellenas) [CO2].
|
Los valores son medias ±SE de especies en cada tipo fotosintetico (Pinto et al. 2014). Panicum milioides (C3–C4) presentó eficiencia en el uso de nitrogeno fotosintetico comparado con Panicum bisulcatum (C3) en CO2 al ambiente y menos en CO2 Glacial.
El contenido de proteína en plantas con el mecanismo fotosintético C4 podría significar una ventaja comparativa por que serian mas digestibles por mamíferos que las plantas con el mecanismo fotosintético C3. Mamíferos que se alimentan con gramíneas C4 y tomarían ventaja del contenido de proteína. Un ejemplo es presentado en el artículo de Griffith et al. (2017), quienes estudiaron la relación histórica entre los herbívoros y la vegetación de los pastizales de EE. UU. A lo largo de los años utilizando el isotopo de carbono C δ13. Ellos encontraron que el Bisonte (Figura 3) podría tener una fuerte preferencia por gramíneas C4 a través de los años, mencionando el impresionante nivel de estabilidad que existe entre los pastizales C4 y la comunidad de bisontes cuando ellos relacionaron las concentraciones del isotopo de carbono en los tejidos de bisonte (1739 DC) y la composición de gramíneas C3 y C4 en los pastizales de Norte América.
Figura 3. Una manada de Bisontes en su camino al valle de Lamar. Debido a las altas tasas de supervivencia y reproducción, las poblaciones de bisontes incrementan de 10 a 17% cada año: diez veces más rápido que el crecimiento de la población humana en el mundo. Foto: NPS / Neal Herbert.
Fuente: https://www.nps.gov/yell/learn/management/bison-management.htm
Otro estudio que incluye digestibilidad in vitro entre Stipa comata (C3) y Bouteloua gracilis (C4) fue presentado por Morgan et al. (2004). Ellos encontraron que la digestibilidad un vitro de Stipa comata (C3), que es la gramínea dominante del pastizal experimental de los Llanos Centrales de Colorado EE. UU., expuesta a un elevado Co2 ambiental fue menor que Bouteloua gracilis (C4) (Figura 4). Estos resultados implican la reducción de calidad de forraje en pastizales dominados por gramíneas C3.
Los animales en pastoreo tienden a seleccionar especies de alta calidad y dejar en el campo especies de baja calidad. Este comportamiento puede ser motivo de preocupación debido a que los pastizales utilizados para el pastoreo y dominados por especies C3 podrían ser menos palatables bajo los efectos del cambio climático (Morgan et al. 2004).
Figure 4. Digestibilidad in vitro de materia seca de Pascopyrum smithii, Stipa comata y Bouteloua gracilis (promedios de 2 años) al ambiente y con elevado CO2 (360 and 720 µmol/mol) cámaras de apertura superior y controles sin cámara en la estepa del este de Colorado. Promedios con letras diferentes son significativamente diferentes usando la Prueba de Tukey (P<0.05); las barras de error representan ± 1 la desviación estándar (Morgan et al. 2004).
Mas estudios usando digestibilidad in vivo deben ser desarrollados para confirmar la idea de la ventaja ecológica que pudieran tener las gramíneas C4 en respuesta al cambio climático. Estudios que consideren evaluaciones a largo plazo de gramíneas para caracterizar la respuesta de las especies al cambio climático pueden ser útiles también, para ayudar a desarrollar predicciones del futuro comportamiento de gramíneas C4 (Zelikova et al, 2014).
Este es un tema muy interesante para mi así que me gustaría saber ¿Qué les pareció mi respuesta? ¿Conoces alguna otra ventaja que puedan tener las gramíneas C4 en un escenario de cambio climático? Déjenme su opinión en la sección de comentarios y hasta la próxima entrada.
Referencias
Gibson, D. (2009) Grasses and Grassland Ecology. Oxford University press. Pg. 58-73.
Griffith DM, Cotton JM, Powell RL, Sheldon ND, Still CJ. (2017). Multi-century stasis in C3 and C4 grass distributions across the contiguous United States since the industrial revolution. J Biogeogr. 44 (11): 2564–2574.
Kirkham, M.B. (2016). Elevated Carbon Dioxide Impacts on soils and water relations. C.R.C. Press. Pg. 7, 8.
Morgan, J. A., Mosier, A. R., Milchunas, D. G., LeCain, D. R., Nelson, J. A. and Parton, W. J. (2004), CO2 Enhances Productivity, Alters Species Composition, and Reduces Digestibility of Shortgrass Steppe Vegetation. Ecological Applications, 14: 208–219.
Pinto, H. Sharwood, R. Tissue, D. Ghannoum, O. (2014). Photosynthesis of C3, C3-C4, and C4 grasses al glacial CO2. Journal of Experimental Botany, 65(13): 3669-3681.
Sage RF, Sage TL, Kocacinar F. (2012). Photorespiration and the evolution of C4 photosynthesis. Annual Review of Plant Biology 63, 19–47.
Zelikova, T. J., Blumenthal, D. M., Williams, D. G., Souza, L., LeCain, D. R., Morgan, J., & Pendall, E. (2014). Long-term exposure to elevated CO2 enhances plant community stability by suppressing dominant plant species in a mixed-grass prairie. Proceedings of the National Academy of Sciences of the United States of America, 111(43), 15456–15461.



Comentarios
Publicar un comentario